Tras haber visto el agua, las sales minerales, y los carbohidratos, las proteínas son la segunda macromolécula orgánica que estudiaremos, dentro de la unidad "Composición Química de los Seres Vivos".
1. Composición química: C-H-O-N-S (¿a qué átomos corresponden estos símbolos químicos?
2. Monómeros y Polímeros
- Los monómeros de las proteínas se llaman amino ácidos o péptidos. Ahora, los amino ácidos están hechos de distintos componentes, o distintos grupos funcionales, como lo muestra el siguiente diagrama:
El ámino ácido tiene, en torno al "C" que vemos en el esquema, llamado carbono central, un grupo amino: NH2, un grupo carboxilo: COOH, un hidrógeno: H, y una cadena lateral o radical: R. Con cadena lateral nos referimos a que, en esa ubicación, se pueden ubicar muchas cosas, desde un simple átomo de hidrógeno, a grandes grupos de átomos.
Existen 20 amino ácidos en total. De estos, el cuerpo humano puede producir sólo 10. O sea, hay otros 10 amino ácidos que el cuerpo NO puede producir por si solo. Por ende, estos los debemos obtener de los alimentos que comemos. Por esto mismo, a los amino ácidos que no podemos producir los llamamos "esenciales": es "esencial" que los comamos (esencial=absolutamente necesario). Los otros 10 amino ácidos, son los amino ácidos no esenciales.
Pregunta de reforzamiento: ¿Qué parte del amino ácido (con parte nos referimos a grupo amino, grupo carboxilo, etc.) va a marcar la diferencia entre los 20 amino ácidos que existen?
- Los polímeros resultan de la unión de los monómeros. Entonces, muchos amino ácidos unidos van a forman a las proteínas, o a los polipéptidos (poli=muchos. Por ende polipéptido quiere decir "muchos péptidos"). Los polipéptidos pueden tener hasta miles de amino ácidos, unidos todos en fila.
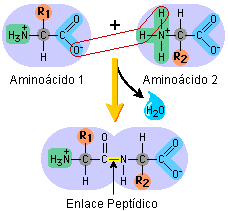
- El proceso de la polimerización forma la unión entre dos monómeros para formar un polímero. En el caso de las proteínas, esta unión (o enlace) se llama enlace peptídico (por péptido). Los amino ácidos no se unen de cualquier manera entre si, si no que lo hacen de manera ordenada. El grupo carboxilo de un amino ácido, se unirá con el grupo amino del otro amino ácido, para poder así formar largas cadenas de amino ácidos. Veamos el siguiente esquema:
Vemos que, cada vez que unimos un amino ácido con otro, por el grupo carboxilo COOH de uno con el grupo amino NH2 del otro, se forma una molécula de agua, H2O.
Resumen: Siguiendo la línea de las clases anteriores, el amino ácido es la pieza chica de lego, que, al juntarse con otros amino ácidos, otras piezas de lego, formarán a las proteínas, que serían pues grandes cadenas de lego. Cuando juntamos las dos piezas de lego, existe entre ellas un enlace peptídico. Si recordamos que en la unión de amino ácidos sólo participa el grupo carboxilo COOH de uno, con el grupo amino NH2 de otro, entonces vemos que las piezas de lego pueden unirse sólo por algunos lados. Digamos que el lado derecho de la pieza de lego es el COOH, y el izquierdo el NH2. Las piezas de lego las iremos juntando lado derecho con lado izquierdo, lado derecho con lado izquierdo. Es decir, la filita de amino ácidos, que es el polipéptido, la iríamos armando de izquierda a derecha.
3. Estructura de las proteínas
- Existen cuatro niveles de estructuración de las proteínas: primario, secundario, terciario, y cuaternario.
- Estructura primaria: la fila de amino ácidos, todos unidos por medio de enlaces peptídicos. Es lo que primero se obtiene, tratando de formar una proteína.
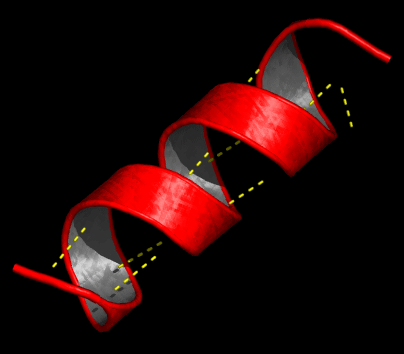
- Estructura secundaria: la fila de amino ácidos se dobla, se plega, sobre si misma, como si enrollamos una cinta alrededor de algo. Pueden formarse dos formas principales: alfa hélice y lámina beta (diagramas abajo)
- Estructura terciaria: la estructura secundaria se sigue doblando.
- Estructura cuaternaria: se unen dos proteínas con estructura terciaria.
O sea, vemos que cada nivel forma proteínas más complejas, más difíciles de ver, que el anterior. Por eso que hablamos de que la estructura que puede adoptar una proteína es como una escalera: del peldaño de más abajo, el primero, se pasa al segundo. Sólo estando en segundo se puede subir al tercero, para después ir al cuarto que es el peldaño de más arriba, o sea, el más complicado.
4. Propiedades de las proteínas
- Desnaturación: Las proteínas pueden perder la estructura de la cual hablamos anteriormente, por diversos factores de desnaturación: pH (si están en un lugar ácido o básico), alzas en la temperatura, o agitación mecánica. La desnaturación funciona de la misma manera que la escalera de la cual hablamos antes, pero en vez de subir peldaños, bajamos peldaños. Si desnaturo una proteína con estructura 4, pasa a ser una proteína de estructura 3. Si desnaturo esta proteína, se convierte en una de estructura 2, y si desnaturo esta también, pasa a ser la proteína de estructura 1.
Pregunta de reforzamiento: si sabemos que "desnaturar" es lo mismo que "perder la estructura", ¿podemos desnaturar una proteína de estructura primaria? (pensar: ¿a qué escalón se iría?).


No hay comentarios:
Publicar un comentario